令和4年6月30日終了
農学研究院 浅野 眞一郎 教授(応用分子昆虫学研究室)
背景・目的
Bacillus由来のCry毒素をスクリーニングするには従来法であれば、大腸菌やBacillus菌(B. subtilisや
B. thuringiensis等)で大量発現させて、精製する必要があり時間と手間がかかった。
防除対象害虫のレセプター分子を大量発現させる方法としては、昆虫由来培養細胞にてバキュロウイ
ルスを使うことで可能であったが、Cry毒素とCry毒素レセプターとの結合特性を調べるのは煩雑な手
順での実験となる。上記の2つの手法を組み合わせた方法では、多検体のCry毒素でのハイスループ
ットスクリーニングには適さない。
殺虫活性の強いCry毒素を選抜するハイスループットスクリーニング法を開発することを目的とした。
研究内容
B. subtilis(Bs)のスポア表面にCry毒素を発現させた。Cry毒素を発現させたBsスポアと野生型の
BsスポアをCry毒素抗体でラベルしCry毒素を発現しているスポアだけをフローサイトメトリーで
分けられた。
昆虫個体(カイコ)もしくは昆虫由来培養細胞で当研究室で開発されたバキュロベクター発現システム
を用いることでCry毒素レセプターを大量発現させ、可溶化したのち付加したタグ(FLAGタグ)で精製させることができた。その精製したCry毒素レセプターとCry毒素発現Bsスポアの結合親和性で、レセプターに結合するCry毒素をソーティングする方法を確立した。
Cry毒素発現BsスポアをCry毒素レセプター発現させた昆虫培養細胞に投与することで、細胞が膨張、破裂させることが確認された。
成果報告
- B. subtilis(Bs)のスポア表面にCry毒素を発現させるためのベクターシステムを構築した。
- Bsのスポア表面にCry毒素が発現されているかを確かめるために、蛍光色素標識したCry毒素抗体で蛍光顕微鏡にて確認した。(図1)
- Cry毒素を発現させたBsスポアと野生型のBsスポアをCry毒素抗体でラベルしフローサイトメトリーでソーティングすることで、Cry毒素発現Bsスポアを選抜できた。(図2)
- Cry毒素発現Bsスポアを、バキュロベクター発現システムでCry毒素レセプターを発現させた培養細胞に投与することで、細胞を膨張、破裂させることが確認された。
- 昆虫個体もしくは昆虫由来培養細胞でCry毒素レセプターを大量発現させ、可溶化したのち付加したタグ(FLAGタグ)で精製した。その精製したCry毒素レセプターとCry毒素発現Bsスポアと結合させて、Cry毒素レセプターに結合したCry毒素発現BsスポアをFLAGタグでソーティング選抜した。
この成果については、以下の特許申請中である。
「COMPOSITIONS AND METHODS FOR SCREENING INSECTICIDAL PROTEINS」
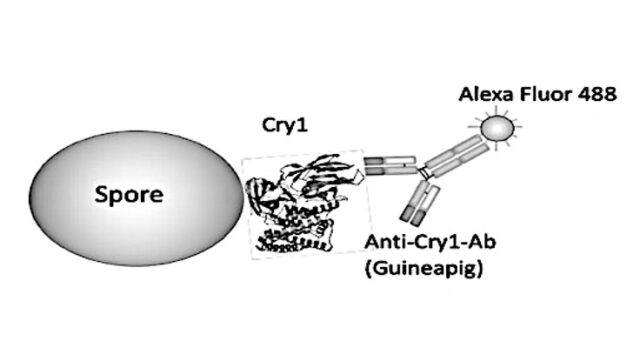
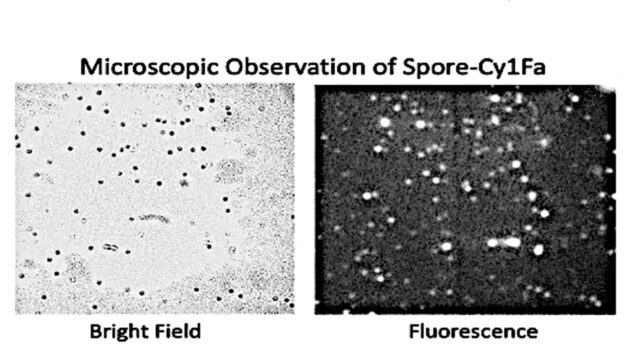
図1 Bsスポア表面のCry毒素発現確認実験
A Bsスポア発現Cry1毒素に対する蛍光ラベル抗体の結合概念図
B Bsスポア発現Cry毒素の蛍光顕微鏡での確認
“Bright Field”は、励起光なしでのBsスポアの観察
“Fluorescence”は、励起光下でのBsスポアの観察
図2 フローサイトメトリーでのCry毒素発現Bsスポアのソーティング
A 野生型のBsスポアとCry毒素発現Bsスポアを10:1で混合し、蛍光標識した
Cry毒素抗体の励起光でソーティングした結果
B AでソーティングされたCry毒素発現Bsスポア画分を再度ソーティングした結果